Hydrider: Egenskaper, Typer, Nomenklatur och Exempel
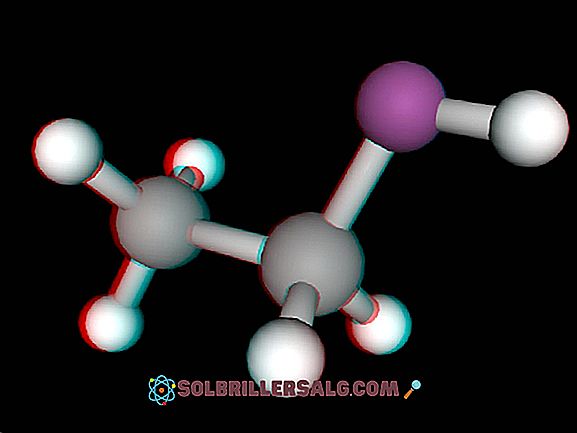
En hydrid är väte i sin anjonform (H-) eller föreningar som bildas från kombinationen av ett kemiskt element (metalliskt eller icke-metalliskt) med väteanjonen. Av de kända kemiska elementen är väte den som är den enklaste strukturen, för när den är i atomstaten har den en proton i sin kärna och en elektron.
Trots detta finns väte endast i sin atomform under förhållanden med relativt höga temperaturer. Ett annat sätt att identifiera hydrider är när det observeras att en eller flera centrala väteatomer i en molekyl har ett nukleofilt beteende, som ett reduktionsmedel eller till och med som en bas.

Vätgas har således förmågan att kombinera med de flesta element i det periodiska bordet för att bilda olika substanser.
Hur bildas hydrider?
Hydrider bildas när väte i sin molekylära form är associerat med ett annat element, antingen av metalliskt eller icke-metalliskt ursprung, direkt genom att dissociera molekylen för att bilda en ny förening.
På detta sätt bildar väte bindningar av kovalent eller jontyp, beroende på typen av element med vilken den kombineras. Vid associering med övergångsmetaller bildas interstitiella hydrider med fysikaliska och kemiska egenskaper som kan variera kraftigt från en metall till en annan.
Förekomsten av friformiga hydridanjoner är begränsad till tillämpningen av extrema förhållanden som inte uppträder lätt, så i vissa molekyler är oktettregeln inte uppfylld.
Det är möjligt att andra regler relaterade till fördelningen av elektroner inte ges, att behöva tillämpa uttryck för länkar i flera centra för att förklara bildandet av dessa föreningar.
Fysikaliska och kemiska egenskaper hos hydrider
När det gäller fysikaliska och kemiska egenskaper kan man säga att egenskaperna hos varje hydrid beror på vilken typ av bindning som utförs.
När exempelvis hydridanjonen är associerad med ett elektrofilt centrum (vanligtvis är det en omättad kolatom) uppträder den bildade föreningen som ett reduktionsmedel, vars användning är mycket utbredd vid kemisk syntes.
I motsats härtill, när de kombineras med element som alkalimetaller, reagerar dessa molekyler med den svaga syran (Bronsted acid) och beter sig som starka baser och frigör vätgas. Dessa hydrider är mycket användbara vid organisk syntes.
Det observeras då att hydriderna är mycket varierade, att de kan bilda diskreta molekyler, fasta ämnen av jontyp, polymerer och många andra ämnen.
Av denna anledning kan de användas som torkmedel, lösningsmedel, katalysatorer eller intermediärer vid katalytiska reaktioner. De har också flera användningsområden i laboratorier eller industrier för olika ändamål.
Metallhydrider
Det finns två typer av hydrider: metalliska och icke-metalliska.
Metallhydrider är de binära substanser som bildas av kombinationen av ett metallelement med väte, allmänt en som är elektropositiva, såsom alkaliska eller jordalkalimetaller, även om interstitiella hydrider ingår också.
Detta är den enda typen av reaktion där väte (vars oxidationsnummer vanligen är +1) har en extra elektron på dess yttersta nivå; det vill säga dess valensnummer omvandlas till -1, även om bindningarnas natur i dessa hydrider inte helt har definierats av skillnaden mellan ämnets forskare.
Metallhydrider har vissa egenskaper hos metaller, såsom hårdhet, ledningsförmåga och ljusstyrka. men till skillnad från metaller har hydrider en viss bräcklighet och deras stökiometri överensstämmer inte alltid med kemiets viktlagar.
Icke-metalliska hydrider
Denna typ av hydrid härrör från den kovalenta föreningen mellan ett icke-metalliskt element och väte, så att det icke-metalliska elementet alltid är i sitt lägsta oxidationsnummer för att alstra en enkelhydrid med var och en.
Det har också att denna typ av föreningar för det mesta är gasformiga vid normala miljöförhållanden (25 ° C och 1 atm). Av denna anledning har många icke-metalliska hydrider låga kokpunkter, på grund av van der Waals-krafterna som anses vara svaga.
Vissa hydrider i denna klass är diskreta molekyler, andra tillhör gruppen polymerer eller oligomerer och även väte som har gått igenom en kemisorptionsprocess på en yta kan ingå i denna lista.
Nomenklatur, hur heter de?
För att skriva formeln för metallhydrider, börja med att skriva metallen (symbolen för metallelementet) följt av väte (MH, där M är metallen).
För att namnge dem börjar med ordet hydride följt av metallets namn ("M hydrid"), så LiH läser "litiumhydrid", läser CaH 2 "kalciumhydrid" och så vidare.
När det gäller icke-metalliska hydrider är motsatt skrivet för metallhydrider; det vill säga, det börjar med att skriva väte (dess symbol) som hänt av icke-metallen (HX, där X är den icke-metalliska).
För att namnge dem, börja med namnet på det icke-metalliska elementet och lägg till suffixet "uro" och sluta med orden "väte" ("X-uro de hydrogen"), så HBr läser "vätebromid", H 2 S läser "vätesulfid" och så vidare.
exempel
Det finns många exempel på metall- och icke-metallhydrider med olika egenskaper. Här är några som nämns:
Metallhydrider
- LiH (litiumhydrid).
- NaH (natriumhydrid).
- KH (kaliumhydrid).
- CsH (cesiumhydrid).
- RbH (rubidiumhydrid).
- BeH2 (berylliumhydrid).
- MgH2 (magnesiumhydrid).
- CaH2 (kalciumhydrid).
- SrH2 (strontiumhydrid).
- BaH2 (bariumhydrid).
- AlH3 (aluminiumhydrid).
- SrH2 (strontiumhydrid).
- MgH2 (magnesiumhydrid).
- CaH2 (kalciumhydrid).
Icke-metalliska hydrider
- HBr (vätebromid).
- HF (vätefluorid).
- HI (vätejodid).
- HCl (väteklorid).
- H2S (vätesulfid).
- H 2 Te (väte tellurid).
- H 2 Se (väte selenid).