Vad är kemiens viktlagar? (Med exempel)
Kemins viktlagar är de som har visat att massorna av de ämnen som reagerar inte gör det på godtyckligt eller slumpmässigt sätt. men upprätthåller en konstant matematisk andel av heltal eller submultipler av dem, där elementenes atomer inte skapas eller förstörs.
I det förflutna krävdes det att extraordinära ansträngningar gjordes för att upprätta dessa lagar. för även om det nu verkar vara uppenbart, innan vi inte ens visste de atomära eller molekylära massorna av elementen eller föreningarna.

Eftersom det inte var känt exakt hur mycket en molekylat atomer av varje element liknade, måste kemisterna från artonhundra och nittonde århundradena förlita sig på reaktiva massor. Så de rudimentära analytiska saldorna (toppbilden) var oskiljaktiga följeslagare under hundratals experiment som var nödvändiga för avgörandet av viktlagarna.
Det är av den anledningen att när man studerar dessa kemikalielagar man möter massmätningar vid varje ögonblick. Tack vare detta extrapolerade resultaten av experimenten upptäcktes att rena kemiska föreningar alltid bildas med samma massandel av deras beståndsdelar.
Lag för bevarande av massan
Denna lag säger att i en kemisk reaktion är den totala massan av reaktanterna lika med den totala massan av produkterna; så länge systemet anses vara stängt och det finns ingen utbyte av massa och energi med omgivningen.
I en kemisk reaktion försvinner ämnen inte, men omvandlas till andra ämnen med samma massa. därmed den berömda frasen: "ingenting skapas, inget förstörs, allt förvandlas".
Historiskt lagdes lagen om bevarande av massa i en kemisk reaktion först i 1756 av Mikhail Lomonsov, som i sin dagbok visade resultaten av hans experiment.
Senare år 1774 presenterade Antoine Levoisier, fransk kemiker, resultaten av hans experiment som gjorde det möjligt att fastställa detta; vilken, vissa kallar det också Lavoisiers lag.
-Lavoisier experiment
I Lavoisiers tid (1743-1794) fanns teorin om phlogiston, enligt vilken kropparna hade förmåga att antända eller bränna. Lavoisiers experiment fick göra sig av med denna teori.
Lavoisier utförde många metallförbränningsexperiment. Vi vägde noggrant materialet före och efter förbränningen i en sluten behållare och fann att det var en tydlig viktökning.
Men Lavoiser, baserat på hans kunskaper om syrgasens roll vid förbränning, slog fast att viktökning i förbränning berodde på införlivandet av syre i brinnet. Begreppet metalloxider föddes.
Därför förblev summan av massorna av metaller som utsattes för förbränning och syre oförändrad. Denna slutsats möjliggjorde upprättandet av lagen om bevarande av massan.
-Balans av ekvationer
Lagens bevarande av massorna fastställde behovet av att balansera de kemiska ekvationerna, vilket garanterar att antalet av alla element som ingriper i en kemisk reaktion, både reaktiva och som produkter, är exakt densamma.
Detta är en förutsättning för noggrannheten för de stökiometriska beräkningarna som utförs.
-Cálculos
Moles vatten
Hur många mol vatten kan produceras vid förbränning av 5 mol metan i ett överskott av syre? Visa också att lagen om bevarande av materia är uppfylld.
CH4 + 2O2 => CO2 + 2 H20
Iakttagande av den balanserade ekvationen för reaktionen dras slutsatsen att 1 mol metan producerar 2 mol vatten.
Problemet kan lösas direkt med ett enkelt tillvägagångssätt, eftersom vi inte har 1 mol men 5 mol CH 4 :
Moles vatten = 5 mol CH4 (2 mol H20 / 1 mol CH4)
= 10
Detta skulle motsvara 180 g H20. Även 5 mol eller 220 g CO2 bildades, vilket motsvarar en total massa av 400 g produkter.
För att uppfylla lagen om bevarande av materia måste 400 g reaktanter reagera. inte mer, inte mindre. Av dessa 400 g motsvarar 80 g 5 mol CH4 (multiplicerat med molekylmassa 16 g / mol) och 320 g till 10 mol O2 (likaledes för dess molekylmassa av 32 g / mol ).
Förbränning av ett magnesiumband
En magnesiumband av 1, 50 g brändes i en sluten behållare innehållande 0, 80 g syre. Efter förbränningen kvarstod 0, 25 g syre i kärlet. a) Vilken mängd syre reagerade? b) Hur mycket magnesiumoxid bildades?
Massan av syre som reagerade erhålls med en enkel skillnad.
Oxygenmassa förbrukad = (ursprunglig massa - restmassa) syre
= 0, 80 g - 0, 25 g
= 0, 55 g O2 (a)
Enligt lagen om bevarande av massan,
Magnesiumoxidmassa = massa magnesium + massa syre
= 1, 50 g + 0, 55 g
= 2, 05 g MgO (b)
Lag av de definierade proportionerna
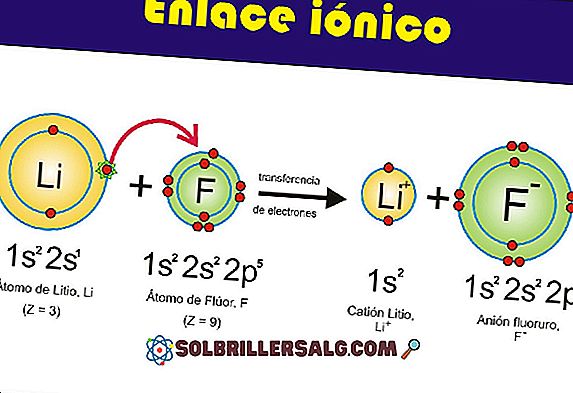
Joseph Louis Proust (1754-1826), en fransk kemiker, insåg att i en kemisk reaktion reagerar de kemiska elementen alltid i fasta massförhållanden för att bilda en specifik ren förening; Därför är dess sammansättning konstant, oberoende av källa eller ursprung, eller hur det syntetiseras.
Proust i 1799 formulerade lagen med bestämda proportioner, som säger att: "När två eller flera element kombineras för att bilda en förening gör de det i ett fast massförhållande." Då är detta förhållande fixerat och beror inte på den strategi som följdes för framställning av föreningen.
Denna lag kallas också lagen av konstant komposition, som säger att: "Varje kemisk förening i ett tillstånd av renhet innehåller alltid samma element, i en konstant massaandel."
-Läggning av lagen
Järn (Fe) reagerar med svavel (S) för att bilda järn sulfid (FeS), vi kan påpeka tre situationer (1, 2 och 3):

För att hitta den andel i vilken elementen kombineras delas den större massan (Fe) med den mindre massan (S). Beräkningen ger ett förhållande på 1, 75: 1. Detta värde upprepas i de tre givna förhållandena (1, 2 och 3), där samma andel uppnås trots att olika massor används.
Det vill säga, 1, 75 g Fe kombineras med 1, 0 g S för att ge 2, 75 g FeS.
-applikationer
Genom att tillämpa denna lag kan man exakt veta massorna av de element som måste kombineras för att erhålla en önskad massa av en förening.
På detta sätt kan information erhållas om överskottsmassan av några av elementen som är involverade i en kemisk reaktion eller om det finns ett reaktivt reagens i reaktionen.
Dessutom appliceras det för att känna den centesima sammansättningen av en förening, och baserat på det senare kan formeln för en förening etableras.
Centesimal sammansättning av en förening
Koldioxid (CO 2 ) bildas i följande reaktion:
C + 02 => CO2
12 g kol kombinerar 32 g syre för att ge 44 g koldioxid.
Så procentandelen kol är lika med
Carbonprocent = (12 g / 44 g) · 100%
= 27, 3%
Oxygenprocent = (32 g / 44 g) · 100%
Syreprocent = 72, 7%
Med hjälp av uttalandet om konstantkompositionens lag kan det noteras att koldioxid alltid består av 27, 3% kol och 72, 7% syre.
-Cálculos
Svaveltrioxid
Vid reaktion i olika behållare erhölls 4 g och 6 g svavel (S) med syre (O), 10 g och 15 g svaveltrioxid (SO 3 ).
Varför uppnåddes sådana mängder svaveltrioxid och inte andra?
Beräkna också mängden svavel som behövs för att kombinera med 36 g syre och den erhållna mängden svaveltrioxid.
Del a)
I det första kärlet blandas 4 svavel med X g syre för att erhålla 10 g trioxid. Om lagen om bevarande av massan tillämpas, kan vi rensa massan av syre som kombinerades med svavel.
Syrgasmassa = 10 g syre-trioxid - 4 g svavel.
= 6 g
I kärl 2 blandas 6 g svavel med X g syre för erhållande av 15 svaveltrioxid.
Syrgasmassa = 15 g svaveltrioxid - 6 g svavel
= 9 g
O / S-proportionerna beräknas sedan för varje behållare:
O / S-förhållande i läget 1 = 6 g O / 4 g S
= 1, 5 / 1
O / S-förhållande i läget 2 = 9 g O / 6 g S
= 1, 5 / 1
Vilket är i överensstämmelse med den upphöjda saken i lagen om de definierade proportionerna som indikerar att elementen alltid kombineras i samma proportion för att bilda en viss förening.
Därför är de erhållna värdena korrekta och de som motsvarar tillämpningen av lagen.
Del b)
I föregående avsnitt beräknades ett värde på 1, 5 / 1 för O / S-förhållandet.
g av svavel = 36 av syre · (1 g svavel / 1, 5 g syre)
= 24 g
g svaveltrioxid = 36 g syre + 24 g svavel
= 60 g
Klor och magnesium
Klor och magnesium kombineras i proportionen av 2, 95 g klor för varje g magnesium. a) Bestäm klor och magnesiummassorna som krävs för att erhålla 25 g magnesiumklorid. b) Vad är procentuell sammansättning av magnesiumklorid?
Del a)
Baserat på värdet 2, 95 för Cl: Mg-förhållandet kan följande tillvägagångssätt göras:
2, 95 g Cl + 1 g Mg => 3, 95 g MgCl2
då:
g Cl = 25 g MgCl2 · (2, 95 g Cl / 3, 95 g MgCl2)
= 18, 67
g Mg = 25 g MgCl2 · (1 g Mg / 3, 95 g MgCl2)
= 6, 33
Därefter kombineras 18, 67 g klorid med 6, 33 g magnesium för att ge 25 g magnesiumklorid.
Del b)
Molekylmassan av magnesiumklorid, MgCl2, beräknas först:
Molekylvikt MgCl2 = 24, 3 g / mol + (2 35, 5 g / mol)
= 95, 3 g / mol
Magnesiumprocent = (24, 3 g / 95, 3 g) x 100%
= 25, 5%
Klorprocentandel = (71 g / 95, 3 g) x 100%
= 74, 5%
Lag av flera proportioner eller Daltons lag
Lagen utgavs 1803 av den franska kemisten och meteorologen John Dalton, baserat på hans observationer angående reaktionerna i atmosfäriska gaser.
Lagen formulerades på följande sätt: "När element kombineras för att ge mer än en förening, en rörlig massa av en av dem sammanfogar en fast massa av den andra och den första har som ett samband med kanoniska och otaliga tal".
Också: "När två element kombineras för att härleda olika föreningar, ges en bestämd mängd av en av dem, är de olika mängderna av det andra elementet som kombineras med denna fasta mängd för att framställa föreningarna i förhållande till enkla heltal".
John Dalton gjorde den första moderna beskrivningen av atomen som en del av de kemiska elementen, när han påpekade att elementen bildas av odelbara partiklar som heter atomer.
Dessutom postulerade han att föreningar bildas när atomer av olika element kombineras med varandra i enkla heltalsproportioner.
Dalton avslutade Prousts utredningsarbete. Han påpekade förekomsten av två tennoxider, med procentandelar 88, 1% och 78, 7% tenn med motsvarande procentandelar syre, 11, 9% respektive 21, 3%.
-Cálculos
Vatten och väteperoxid
Visa att föreningarna vatten, H2O och väteperoxid, H2O2, överensstämmer med lagen om flera proportioner.
Atomvikter av elementen: H = 1 g / mol och syre = 16 g / mol.
Molekylvikter av föreningarna: H20 = 18 g / mol och H2O2 = 34 g / mol.
Väte är elementet med en fast mängd i H2O och H2O2, så proportionerna mellan O och H i båda föreningarna kommer att etableras.
O / H-förhållande i H2O = (16 g / mol) / (2 g / mol)
= 8/1
O / H-förhållande i H2O2 = (32 g / mol) / (2 g / mol)
= 16/1
Förhållande mellan båda proportionerna = (16/1) / (8/1)
= 2
Därefter är förhållandet mellan O / H-förhållandet mellan väteperoxid och vatten 2, ett helt och enkelt nummer. För vad det påvisas uppfyllandet av lagen om de flera proportionerna.
Kväveoxider
Vilken mängd syre kombineras med 3, 0 g kväve i a) kväveoxid, NO och b) kvävedioxid, NO 2 . Visa att NO och NO 2 följer lagen om flera proportioner.
Kvävemassa = 3 g
Atomvikter: kväve, 14 g / mol och syre, 16 g / mol.
beräkningar
I NO, kombineras en atom av N med 1 atom O, så vi kan beräkna massan av syre som kombineras med 3 g kväve med följande tillvägagångssätt:
g av O = g kväve · (PA.O / PA.N)
= 3 g · (16 g / mol / 14 g / mol)
= 3, 43 g O
I NO 2 kombinerar en atom av N med 2 O atomer, så massan av syre som kombinerar är:
g syrgas = 3 g · (32 g / mol / 14 g / mol)
= 6, 86 g O
O / N-förhållande i NO = 3, 43 g O / 3 g N
= 1, 143
O / N-förhållande i NO2 = 6, 86 g O / 3 g N
= 2, 282
Värdet av förhållandet mellan proportionerna O / N = 2 282 / 1, 143
= 2
Därefter är värdet av förhållandet mellan proportionerna O / N 2, ett helt och enkelt nummer. Därför är lagen om flera proportioner uppfyllda.
Lag av ömsesidiga proportioner
Denna lag formulerad av Richter och Carl F. Wenzel separat fastställer att massförhållandet mellan två föreningar med ett gemensamt element tillåter att bestämma andelen av en tredje förening bland de andra elementen om de reagerar.
Om du till exempel har de två föreningarna AB och CB kan du se att det gemensamma elementet är B.
Richter-Wenzel-lagen eller de ömsesidiga proportionerna säger att, att veta hur mycket A reagerar med B för att ge AB, och hur mycket C som reagerar med B för att ge CB, kan man beräkna massan av A som behövs för att reagera med en massa C för att bilda AC.
Och resultatet är att förhållandet A: C eller A / C måste vara en multipel eller submultiple av A / B eller C / B. Men denna lag uppfylls inte alltid, speciellt när elementen har flera oxidationstillstånd.
Av alla viktlagar är detta kanske den mest "abstrakta" eller komplicerade. Men om det analyseras ur matematisk synvinkel kommer det att ses att det bara består av omvandlingsfaktorer och annulleringar.
-Examples
metan
Om det är känt att 12 g kol reagerar med 32 g syre för att bilda koldioxid; och att däremot 2 g väte reagerar med 16 g syre för att bilda vatten, kan massandelarna C / O och H / O för CO2 och H2O uppskattas.
Beräkning av C / O och H / O vi har:
C / O = 12 g C / 32 g O
= 3/8
H / O = 2 g H / 16 g
= 1/8
Syre är elementet gemensamt, och vi vill veta hur mycket kol reagerar med väte för att producera metan; det vill säga vi vill beräkna C / H (eller H / C). Då är det nödvändigt att göra en uppdelning av tidigare proportioner för att visa om ömsesidighet är uppfylld eller ej:
C / H = (C / O) / (H / O)
Observera att O på detta sätt avbryts och C / H förblir:
C / H = (3/8) / (1/8)
= 3
Och 3 är en multipel av 3/8 (3/8 x 8). Detta innebär att 3 g C reagerar med 1 g H för att ge metan. Men för att kunna jämföra det med CO 2, multiplicera C / H med 4, vilket är lika med 12; Detta ger 12 g C som reagerar med 4 g H för att bilda metan, vilket också är sant.
Magnesiumsulfid
Om det är känt att 24 g magnesium reagerar med 2 g väte för att bilda magnesiumhydrid; och att dessutom reagera 32 g svavel med 2 g väte för att bilda vätesulfid, det gemensamma elementet är väte och vi vill beräkna Mg / S från Mg / H och H / S.
Beräkning då Mg / H och H / S separat har vi:
Mg / H = 24 g Mg / 2 g H
= 12
H / S = 2 g H / 32 g S
= 1/16
Det är dock bekvämt att använda S / H för att avbryta H. Därför är S / H lika med 16. När detta är gjort fortsätter vi att beräkna Mg / S:
Mg / S = (Mg / H) / (S / H)
= (12/16)
= 3/4
Och 3/4 är en submultiple på 12 (3/4 x 16). Mg / S-förhållandet indikerar att 3 g Mg reagerar med 4 g svavel för att bilda magnesiumsulfid. Vi måste emellertid multiplicera Mg / S med 8 för att kunna jämföra det med Mg / H. Således reagerar 24 g Mg med 32 g svavel för att ge denna metallsulfid.
Aluminiumklorid
Det är känt att 35, 5 g Cl reagerar med 1 g H för att bilda HCl. På samma sätt reagerar 27 g Al med 3 g H för att bilda AlH3. Beräkna andelen aluminiumklorid och säg om en sådan förening följer Richter-Wenzel-lagen.
Återigen fortsätter vi att beräkna Cl / H och Al / H separat:
Cl / H = 35, 5 g Cl / Ig H
= 35, 5
Al / H = 27 g Al / 3g H
= 9
Nu beräknas Al / Cl:
Al / Cl = (Al / H) / (Cl / H)
= 9 / 35, 5
≈ 0, 250 eller 1/4 (faktiskt 0, 253)
Det vill säga 0, 250 g Al reagerar med 1 g Cl för att bilda motsvarande salt. Men igen måste du multiplicera Al / Cl med ett nummer som gör att du kan jämföra det (med bekvämlighet) med Al / H.
Otillräcklighet i beräkningen
Al / Cl multipliceras sedan med 108 (27 / 0.250), vilket ger 27 g Al som reagerar med 108 g Cl. Detta sker inte exakt så här. Om vi exempelvis tar värdet 0, 253 för Al / Cl och multiplicerar det med 106, 7 (27 / 0, 253), kommer vi att ha 27 g Al reagera med 106, 7 g Cl; vilket är närmare verkligheten (AlCl 3, med en PA på 35, 5 g / mol för Cl).
Här ser vi hur Richters lag kan börja falla på grund av noggrannhet och missbruk av decimaler.