Kaliumhydrid: Struktur, formation, egenskaper och användningsområden
Kaliumhydrid är en jonisk kemisk förening bildad av den direkta kombinationen av väte i sin molekylära form och alkalimetallkalium. Liksom alla andra hydrider av denna typ är det en fast substans, som har en hög smältpunkt som med alla joniska molekyler.
Hydrider är kemiska föreningar som bildas av väte och ett eller flera andra element, metalliska eller icke-metalliska i naturen. Beroende på deras struktur och egenskaper kan dessa ämnen vara av tre typer: joniska, kovalenta eller interstitiella hydrider.

Med naturen av en jonförening består kaliumhydrid av en anjon (i detta fall hydridjonen H-) och en katjon (kaliumjon K +).
Hydridjonen beter sig som en stark Brønsted-bas; det vill säga, det adopterar lätt protoner av ett givarämne som metallkalium, som tar emot dem.
struktur
Kalium identifierades först experimentellt år 1807 av den brittiska kemisten Sir Humphry Davy, liksom andra kemiska beståndsdelar (kalcium, magnesium, bor, strontium och barium) genom elektrolysmetoden.
Det var också denna forskare som upptäckte den kemiska reaktionen som resulterar i bildningen av kaliumhydrid, som uppträder i sin rena form som ett vitt fastämne, fastän reaktanterna som är kommersiellt tillgängliga är gråa.
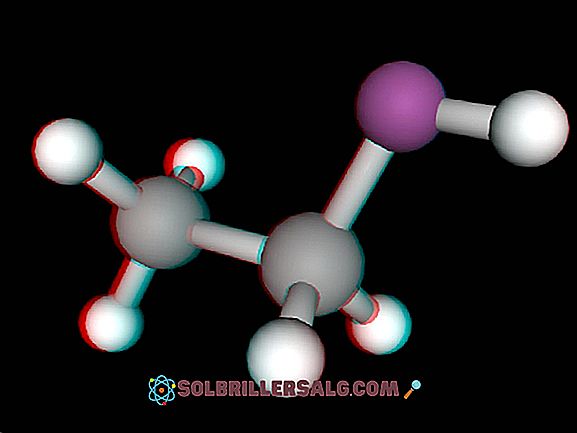
Strukturen hos denna binära hydrid kännetecknas av att den är kristallin, speciellt av den kubiska typen, det vill säga enhetscellen i denna kristall är en kub centrerad på ansikten, såsom framgår av föregående figur.
Reaktionerna som utförs av metallhydriderna förekommer i den kristallina ytan, och denna hydrid har manifesterats för att ha hydridradien och den optimala retikulära energin för denna typ av reaktioner, även över hydriderna av andra metaller.
utbildning
Kaliumhydrid, vars formel representeras som KH, är en oorganisk substans som klassificeras som en alkalimetallhydrid eftersom den bildas genom att direkt kombinera molekylärt väte med kalium genom följande reaktion:
H2 + 2K → 2KH
Denna reaktion upptäcktes av samma forskare som identifierade kalium för första gången. Han insåg hur den här metallen förångas när den utsattes för en vätgasström, när den senare temperaturen ökar under kokpunkten.
Det är också möjligt att producera en kaliumhydrid som har en överlägsen aktivitet på ett enkelt sätt, utgående från en reaktion av väte och andra föreningar av superbasisk natur (såsom kalium-tert-butoxid, kallad t-BuOK-TMEDA) och framställs i hexan.
egenskaper
Kaliumhydrid finns inte spontant i naturen. Den framställs från reaktionen beskriven ovan och finns som ett kristallint fastämne, som sönderdelas vid en temperatur runt 400 ° C innan den når sin smältpunkt.
Denna förening har en molvikt av ungefär 40, 106 g / mol på grund av kombinationen av de molära massorna av dess två komponenter. Dessutom är dess densitet 1, 43 g / cm3 (med referenspunkt tar vattnet under normala förhållanden, vilket är 1, 00 g / cm3).
I detta avseende är det också känt att denna förening har pyroforiska egenskaper; det vill säga det kan antända spontant i närvaro av luft, samt oxidationsmedel och vissa gaser.
Av denna anledning bör det behandlas med försiktighet och innehålla som suspension i en mineralolja eller till och med paraffinvax, vilket minskar dess pyroforicitet och underlättar hanteringen.
löslighet
Vad gäller dess löslighet anses detta hydrid lösligt i smälta hydroxider (såsom smält natriumhydroxid) såväl som i saltblandningar. Å andra sidan är det olösligt i lösningsmedel med organiskt ursprung, såsom dietyleter, bensen eller koldisulfid.
På samma sätt anses det vara en väldigt frätande substans, som också uppenbarar en våldsam reaktion när den kommer i kontakt med föreningar med en sur natur som interagerar i kvantitativt förhållande.
Denna art uppför sig också som ett "superbas" som anses vara ännu starkare än föreningen natriumhydrid; dessutom har den karaktären hos en hydridjondonor.
tillämpningar
Den kaliumhydrid som är kommersiellt tillgänglig, bildad genom reaktion av molekylärt väte med elementärt kalium, har en reaktivitet som är relaterad till de orenheter som den har (främst kalium eller dess reaktionsprodukter), vilket leder till Sekundära reaktioner och utbyten som kan variera.
Dess natur med extrem basicitet gör det väldigt användbart att utföra vissa organiska synteser, liksom i deprotoneringsprocesser av vissa ämnen som har karbonylgrupper för att ge upphov till enolata föreningar.
På samma sätt används kaliumhydrid vid omvandling av vissa aminer till deras motsvarande amider (amider med alkylkedjor av typen KNHR och KNR 2 ) med hjälp av deras deprotonering. På samma sätt utför det en snabb deprotonering i tertiära alkoholer.
Eftersom det är en utmärkt desprotonador används denna förening också i några reaktioner av eliminering, cykliseringskondensation och molekylär omarrangemang och är ett utmärkt reduktionsmedel.
I en annan typ av reaktioner kan en kroneeter fungera som ett fasöverföringsmedel, även om det också kan fungera som ett enkelt "betnings" medel (process för att avlägsna föroreningar) från ytan av kaliumhydrid genom upplösning av de oorganiska salterna som bildas.